杰克森医疗科技(上海)有限公司品牌商
7 年
手机商铺
- NaN
- 0
- 1
- 2
- 1
公司新闻/正文
遗传背景系列知识 | 我的小鼠是什么遗传背景? ——APP/PS1小鼠
362 人阅读发布时间:2025-11-03 16:36
在上一篇推文中,我们探讨了遗传背景对用于代谢研究的经典动物模型 —db 小鼠表型的影响。事实上,遗传背景的影响力不仅局限于代谢领域,它在神经系统表型方面同样起着关键作用。今天,我们将聚焦于阿尔茨海默病(Alzheimer’s Disease,AD)相关动物模型 APP/PS1 小鼠,深入探究遗传背景对其表型的影响。
1991年,Dennis J. Selkoe 2和John Hardy等人 3分别发表文章,阐述了 Aβ 导致 AD 的可能原因(后被称为 Aβ 级联假说),这一理论的提出,标志着 AD 相关研究从单纯的描述性研究迈向了机制研究阶段。同年,Quon等人 4构建了第一个Aβ转基因小鼠,并成功观察到淀粉样斑块沉积等表型。自此,为了更好地研究AD疾病机制,研究者们构建了多种AD动物模型,APP/PS1小鼠便是其中之一。
APP/PS1小鼠的构建可追溯至2001年Jankowsky等人 5对于转基因小鼠构建方法的对比研究。若要获得同时携带两种转基因的小鼠,可选择的方法较为多样,比如将携带单个转基因的小鼠进行相互配繁。但配繁往往需要耗费较多时间,因此有研究者更倾向于在构建之初就让小鼠携带两种甚至更多转基因。在具体构建时,主要有两种策略:一种是把不同的转基因序列构建在不同的表达载体中,随后将它们注射到同一个原核内(共注射,Coinjection Strategy);另一种是把不同序列构建在同一载体上,利用相同的启动子调控它们的表达(双顺反子,Bicistronic Strategy)。采用第一种策略时,不同的表达载体通常会整合到同一位置,从遗传学角度可视为 “单基因” 。
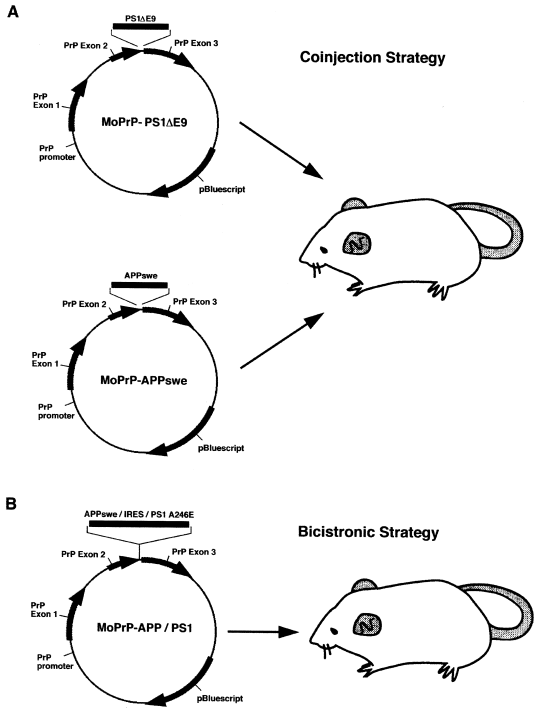
图 1 APP/PS1小鼠构建策略5
基于此,Jankowsky等人使用C57BL/6J与C3H/HeJ杂交子二代胚胎展开相关实验。结果显示,通过共注射策略构建得到的 APP/PS1 小鼠,能够更高效地表达转基因蛋白。后续研究进一步发现,上述载体的确整合到了小鼠 9 号染色体的同一位点6。
目前,JAX可提供两种不同遗传背景的APP/PS1小鼠:
B6;C3-Tg(APPswe,PSEN1dE9)85Dbo/Mmjax (004462):B6;C3混合遗传背景;
B6.Cg-Tg(APPswe,PSEN1dE9)85Dbo/Mmjax (005864):B6同源背景。
虽然携带的转基因相同,上述两种品系的小鼠表型却存在差别。ALZFORUM数据收录了多种可用于神经退行性疾病相关研究的啮齿类动物模型,对于不同模型的构建原理、遗传背景、表型信息等信息进行了详细的说明,同时也一并提供了参考文献,方便我们快速获取大量信息,从而挑选出合适的动物模型。关于如何选择AD动物模型,您可参考“世界阿尔茨海默病日│如何选择AD转基因动物模型 | 杰克森实验室 (jax.org.cn)” ①。
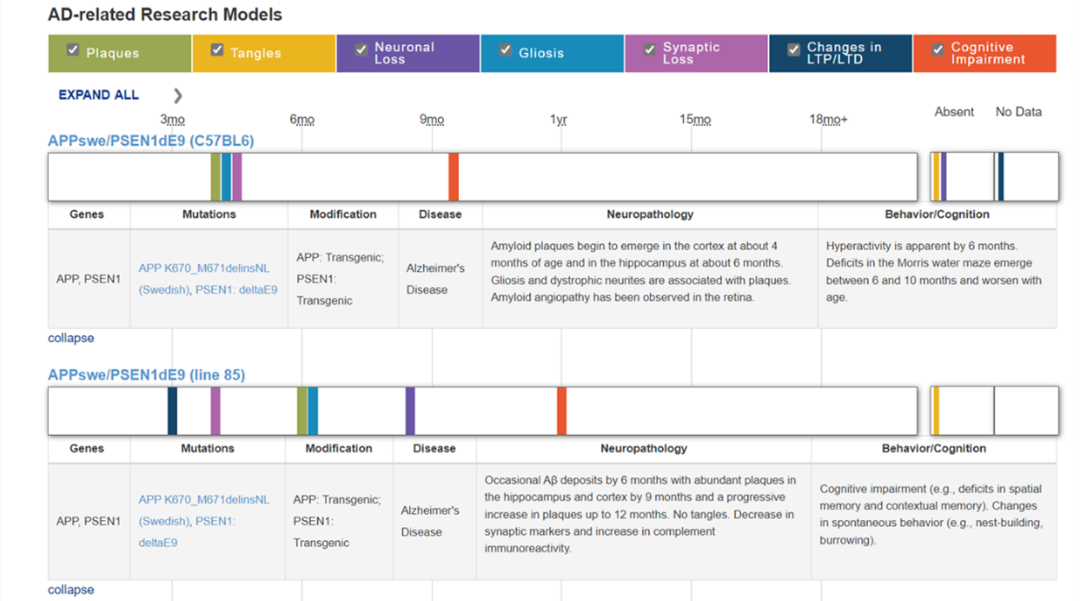
图 2ALZFORUM数据库中关于两种APP/PS1小鼠表型信息的描述
以研究者较为关注的淀粉样斑块沉积为例,B6;C3混合遗传背景的#004462,在9月龄时海马及皮层脑区可出现大量淀粉样斑块7
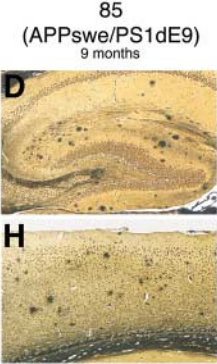
而B6同源遗传背景的#005864,出现淀粉样斑块沉积的时间更早8。
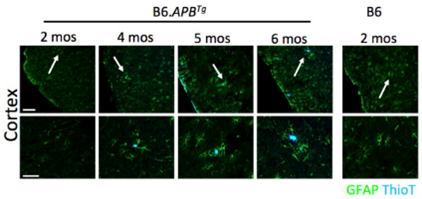
遗传背景的差异还可能带来AD以外的其它表型,例如癫痫。有研究者曾较为详细地对B6遗传背景的APP/PS1小鼠的癫痫表型进行了描述 9。研究人员利用视频脑电图(video-EEG)监测发现,3 - 3.5 月龄的半合子小鼠至少会发生一次癫痫。在 4.5 月龄之前,该品系小鼠的癫痫发生率会增长至 55%。但根据现有记录,B6;C3 混合遗传背景的小鼠并无癫痫症状。
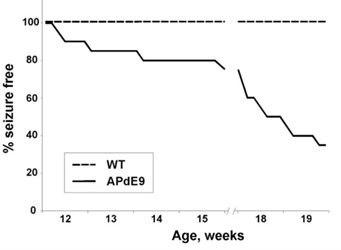
图 3 B6同源遗传背景APP/PS1小鼠(#005864)癫痫发生率9
根据Minkeviciene等人报道9,约有10-15%的B6遗传背景半合子小鼠出现死亡的情况,高峰期位于3-4月。在JAX设施中,B6遗传背景APP/PS1小鼠在15周龄时死亡率约为30%。
在维系种群过程中,有部分研究者由于操作失误或实验需要,将某一品系小鼠与另一背景的品系配繁了一代甚至多代。此时,由于遗传背景改变,很可能观察到不同的表型。由于小鼠不同遗传背景之间的遗传信息差异较大,为了了解小鼠的遗传背景,可考虑采用SNP分析。单核苷酸多样性(Single Nucleotide Polymorphism,SNP)是指在基因组水平上由单个核苷酸的变异所引起的DNA序列多样性。Development of a SNP genotyping panel for genetic monitoring of the laboratory mouse - PubMed (nih.gov)③一文中介绍了利用SNP监测小鼠遗传背景的应用,MGI-Strains and SNPs (jax.org)④数据库中收录了常见背景品系的部分SNP信息,您可根据需要进行选择。
参考文献
-
Guo T et al. “Molecular and cellular mechanisms underlying the pathogenesis of Alzheimer's disease”. Molecular Neurodegeneration. 2020 Jul 16;15(1):40. doi: 10.1186/s13024-020-00391-7. PMID: 32677986; PMCID: PMC7364557.
-
Selkoe DJ. The molecular pathology of Alzheimer's disease. Neuron. 1991 Apr;6(4):487-98. doi: 10.1016/0896-6273(91)90052-2. PMID: 1673054.
-
Hardy J, Allsop D. Amyloid deposition as the central event in the aetiology of Alzheimer's disease. Trends Pharmacol Sci. 1991 Oct;12(10):383-8. doi: 10.1016/0165-6147(91)90609-v. PMID: 1763432.
-
Quon D, Wang Y, Catalano R, Scardina JM, Murakami K, Cordell B. Formation of beta-amyloid protein deposits in brains of transgenic mice. Nature. 1991 Jul 18;352(6332):239-41. doi: 10.1038/352239a0. PMID: 1906990.
-
Jankowsky JL, Slunt HH, Ratovitski T, Jenkins NA, Copeland NG, Borchelt DR. Co-expression of multiple transgenes in mouse CNS: a comparison of strategies. Biomol Eng. 2001 Jun;17(6):157-65. doi: 10.1016/s1389-0344(01)00067-3. PMID: 11337275.
-
Jackson HM, Onos KD, Pepper KW, Graham LC, Akeson EC, Byers C, Reinholdt LG, Frankel WN, Howell GR. DBA/2J genetic background exacerbates spontaneous lethal seizures but lessens amyloid deposition in a mouse model of Alzheimer's disease. PLoS One. 2015 May1;10(5):e0125897.doi:10.1371/journal.pone.0125897. PMID: 25933409; PMCID: PMC4416920.
-
Jankowsky JL, Fadale DJ, Anderson J, Xu GM, Gonzales V, Jenkins NA, Copeland NG, Lee MK, Younkin LH, Wagner SL, Younkin SG, Borchelt DR. Mutant presenilins specifically elevate the levels of the 42 residue beta-amyloid peptide in vivo: evidence for augmentation of a 42-specific gamma secretase. Hum Mol Genet. 2004 Jan 15;13(2):159-70. doi: 10.1093/hmg/ddh019. Epub 2003 Nov 25. PMID: 14645205.
-
Jackson HM, Soto I, Graham LC, Carter GW, Howell GR. Clustering of transcriptional profiles identifies changes to insulin signaling as an early event in a mouse model of Alzheimer's disease. BMC Genomics. 2013 Nov 25;14:831. doi: 10.1186/1471-2164-14-831. PMID: 24274089; PMCID: PMC3907022.
-
Minkeviciene R, Rheims S, Dobszay MB, Zilberter M, Hartikainen J, Fülöp L, Penke B, Zilberter Y, Harkany T, Pitkänen A, Tanila H. Amyloid beta-induced neuronal hyperexcitability triggers progressive epilepsy. J Neurosci. 2009 Mar 18;29(11):3453-62. doi: 10.1523/JNEUROSCI.5215-08.2009. PMID: 19295151; PMCID: PMC6665248.




