杰克森医疗科技(上海)有限公司品牌商
7 年
手机商铺
- NaN
- 0
- 1
- 2
- 1
公司新闻/正文
遗传背景系列知识 | 我的小鼠是什么遗传背景? ——lpr小鼠
324 人阅读发布时间:2025-11-03 16:38
遗传背景就像小鼠的 “隐形剧本”,不仅决定了它们在代谢、神经生物学领域的 “剧情走向”,在免疫系统的 “篇章” 里,也写满了它的影响 —— 比如系统性红斑狼疮(Systemic Lupus Erythematosus, SLE)。
系统性红斑狼疮(SLE)是一种累及多系统、多脏器的自身免疫性炎症性结缔组织病。从致病原理来看,它的发病机制复杂,涉及遗传易感性、环境因素和免疫系统异常的相互作用1。遗传方面,携带特定基因的人群更易发病,比如某些人类白细胞抗原基因2;环境因素则像是导火索,紫外线照射、感染(如 EB 病毒)、药物(如普鲁卡因胺)等,都可能诱发疾病3。当这些因素共同作用于机体时,免疫系统会出现紊乱:原本负责识别和清除外来病原体的免疫细胞,会错误地将自身组织和器官当作 “入侵者” 进行攻击,产生大量自身抗体。这些抗体与体内成分结合形成免疫复合物,沉积在血管壁、关节、肾脏等部位,进而引发一系列炎症反应。

图 1 系统性红斑狼疮病因(源自3)
在疾病表现上,系统性红斑狼疮的症状多样且不典型,容易误诊漏诊。最具特征性的是皮肤症状,患者面部常出现对称性红斑,形似蝴蝶,称为 “蝶形红斑”,此外还可能出现盘状红斑、黏膜溃疡、脱发等;关节肌肉方面,约 90% 的患者有关节痛,可累及多个关节,部分患者还会出现肌肉无力;肾脏受累较为常见,表现为蛋白尿、血尿,严重时可发展为肾衰竭;累及血液系统时,会出现贫血、白细胞减少、血小板减少;当神经系统受累,可能引发头痛、癫痫发作、精神症状等4,5。
在 SLE 的临床前研究中,小鼠模型发挥了不可替代的作用,其中自发性小鼠模型最为常用,包括 NZB、NZBWF1、BXSB 和 MRL-lpr 等6,这些品系的小鼠会表现出广泛的自身免疫特征,且都存在高丙种球蛋白血症和抗核抗体(ANA)升高等 SLE 典型血清学标志。而在这些模型中,MRL-lpr 小鼠因自身免疫表型出现较早、体型较大便于实验操作,受到了研究者们的更多关注。
20 世纪 70 年代中期,杰克森实验室Murphy ED和Roths JB通过对四种不同品系小鼠进行系列杂交,成功培育出易患狼疮的 MRL 品系(Murphy Roths Large)。该品系的遗传背景源于 C57BL/6J(占比 0.3%)、C3H/HeDi(占比 12.1%)、AKR/J(占比 12.6%)和 LG/J(占比 75%)四个品系的杂交组合。在培育这一近交系的过程中,研究人员在 F12 代 MRL 小鼠中发现了显著的淋巴增生现象,并通过后续研究确定致病突变——Fas7。
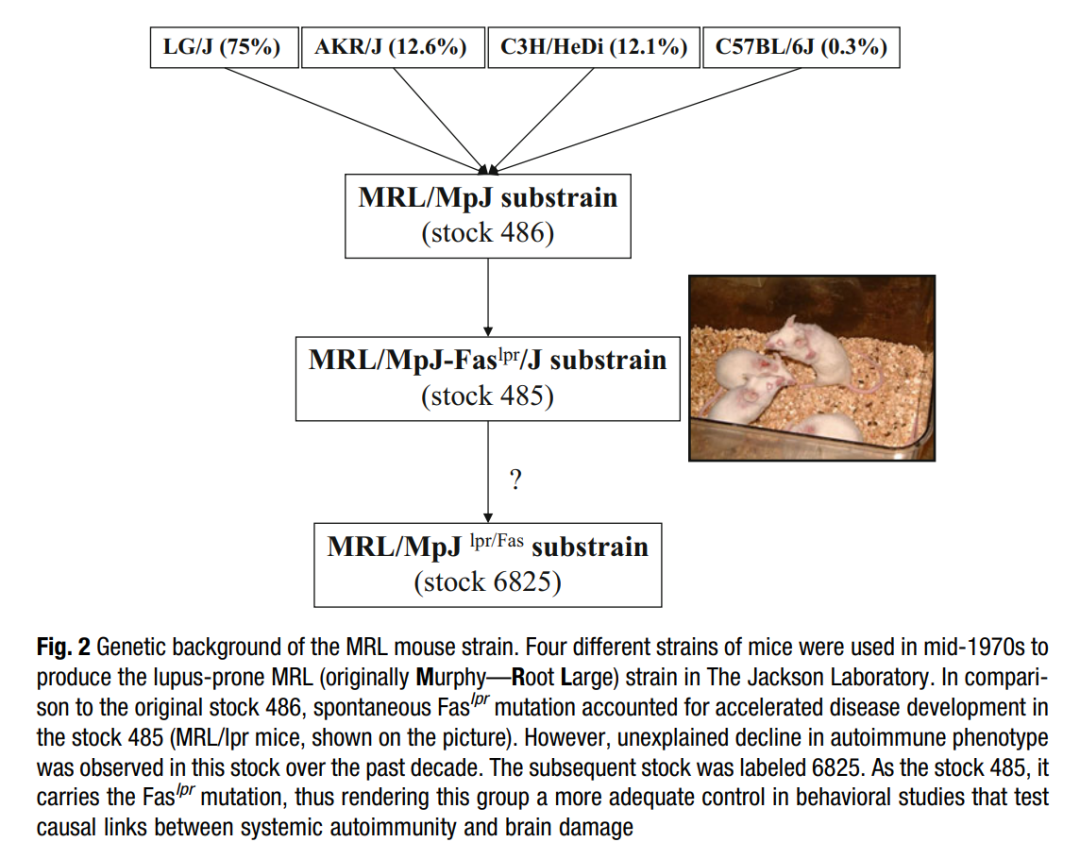
图 2 MRL/lpr动物来源(源自8)
遗传背景对狼疮表型的影响究竟有多大?早在1984年,MRL品系构建者Murphy ED和Roths JB就已尝试将lpr突变转移至其它遗传背景下9,并观察到了明显的抗体数量和类型差异。
1985 年,研究者们开展了更深入的表型分析。在一项研究10中,作者简要比较了 C57BL/6J、C3H/HeJ、AKR/J、SJL/J 和 MRL/MpJ 五种遗传背景下 lpr 小鼠的淋巴增生情况,并重点聚焦 SJL-lpr 小鼠,详细分析了不同基因型小鼠的表型特征。结果发现:10 周龄时,SJL-lpr/lpr 小鼠的淋巴结显著大于其他品系的纯合子 lpr 小鼠;到 26 周龄时,其淋巴结仅略大于 MRL-lpr/lpr 小鼠,小于 C3H-lpr/lpr 小鼠。
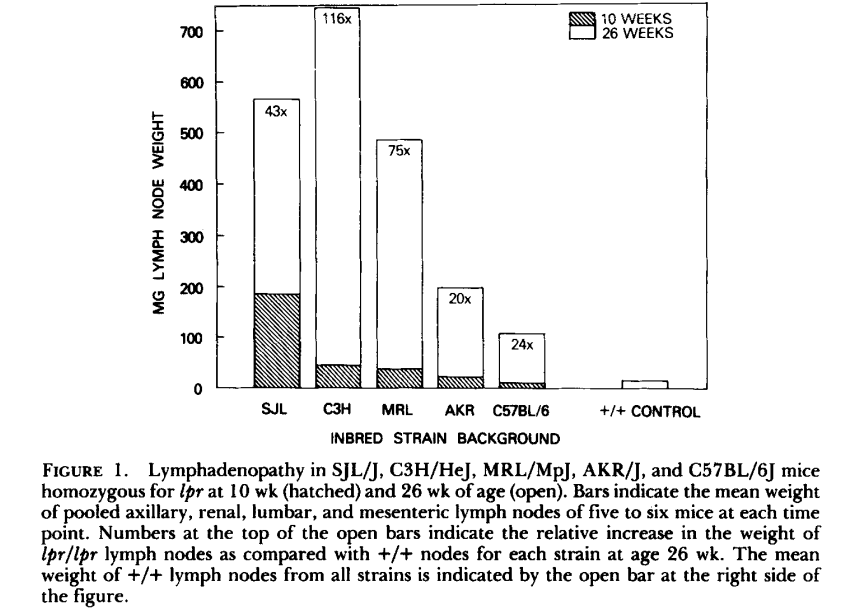
图 3 不同遗传背景下lpr小鼠淋巴结增生情况(源自10)
同年,Roths JB在另一篇文章中详细探讨了三种不同遗传背景(C3H/HeJ、C57BL/6J 和 AKR/J)的 lpr 小鼠在表型上的差异,包括淋巴增生情况、尿蛋白水平和肾脏病理学特征11。研究发现,不同遗传背景的 lpr 小鼠存活期差异明显:
· MRL 遗传背景小鼠寿命最短,半数生存期仅 6 个月;
· B6 和 AKR 遗传背景小鼠半数生存期相当,约为 9 个月;
· C3H 遗传背景下的 lpr 小鼠半数生存期最长,可达 11 个月。
同时,MRL-lpr 小鼠在不同时期会出现明显的淋巴增生和尿蛋白升高,但这一特征在 AKR-lpr 遗传背景的小鼠中并不明显。
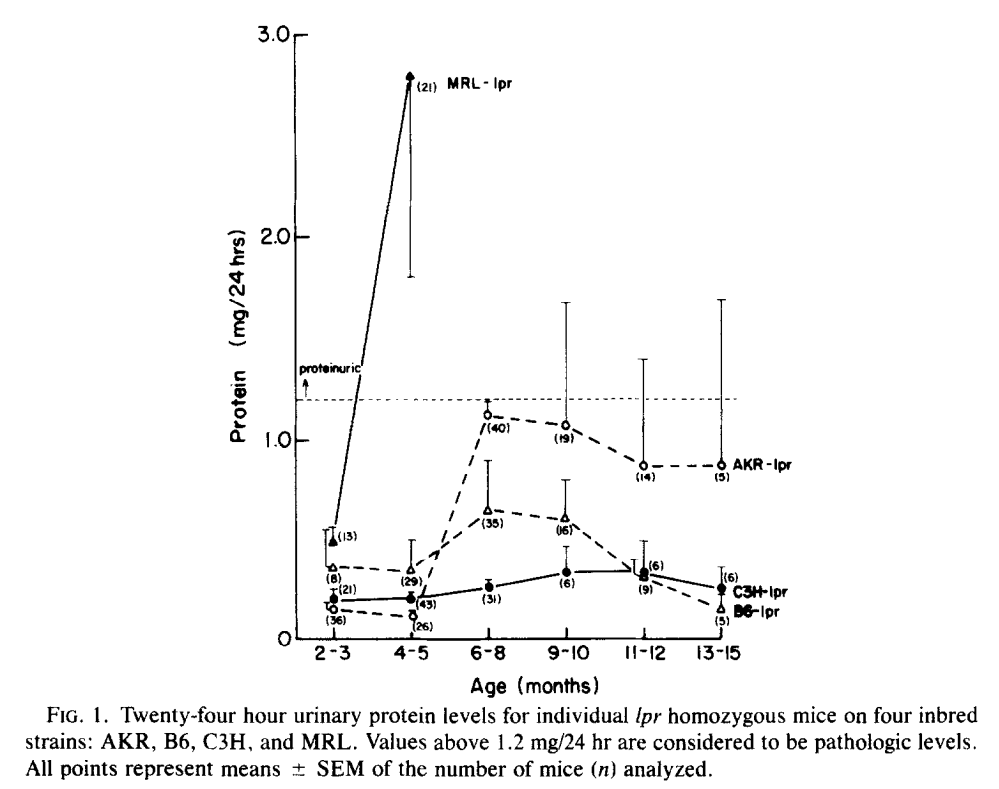
图 4 不同遗传背景下lpr小鼠尿蛋白水平(源自11)
正是由于注意到遗传背景对表型的显著影响,后续研究者们借助杂交小鼠,通过QTL(quantitative trait locus)定位12、微卫星分析13等实验技术,成功确认了多个可能影响狼疮表型的关键位点,为深入理解 SLE 的遗传机制提供了重要线索。
在选择小鼠品系的时候,我们能够从命名中了解到小鼠的遗传背景,关于小鼠品系命名可参看LT0018_小鼠品系标准命名法 (jax.org.cn)。如果您关注的是JAX供应的品系,在小鼠品系详情页“HOW IT’S MADE”--“Development”部分能够看到更为详细的构建过程,及可能引入的背景信息。
小鼠品系详情页“HUSBANDRY”--“Breeding Considerations”部分也列出了配繁建议,您可作为参考。
在维系种群过程中,有部分研究者由于操作失误或实验需要,将某一品系小鼠与另一背景的品系配繁了一代甚至多代。此时,由于遗传背景改变,很可能观察到不同的表型。由于小鼠不同遗传背景之间的遗传信息差异较大,为了了解小鼠的遗传背景,可考虑采用SNP分析。单核苷酸多样性(single nucleotide polymorphism,SNP)是指在基因组水平上由单个核苷酸的变异所引起的DNA序列多样性。Development of a SNP genotyping panel for genetic monitoring of the laboratory mouse - PubMed (nih.gov)一文中介绍了利用SNP监测小鼠遗传背景的应用,MGI-Strains and SNPs (jax.org)数据库中收录了常见背景品系的部分SNP信息,您可根据需要进行选择。
参考文献
-
Justiz Vaillant AA, Goyal A, Varacallo MA. Systemic Lupus Erythematosus. [Updated 2023 Aug 4]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2025 Jan-. Available
-
Ghodke-Puranik Y, Olferiev M, Crow MK. Systemic lupus erythematosus genetics: insights into pathogenesis and implications for therapy. Nat Rev Rheumatol. 2024;20(10):635-648. doi:10.1038/s41584-024-01152-2
-
Woo JMP, Parks CG, Jacobsen S, Costenbader KH, Bernatsky S. The role of environmental exposures and gene-environment interactions in the etiology of systemic lupus erythematous. J Intern Med. 2022;291(6):755-778. doi:10.1111/joim.13448
-
Lazar S, Kahlenberg JM. Systemic Lupus Erythematosus: New Diagnostic and Therapeutic Approaches. Annu Rev Med. 2023;74:339-352. doi:10.1146/annurev-med-043021-032611
-
Siegel CH, Sammaritano LR. Systemic Lupus Erythematosus: A Review [published correction appears in JAMA. 2024 Jun 25;331(24):2136. doi: 10.1001/jama.2024.10468.]. JAMA. 2024;331(17):1480-1491. doi:10.1001/jama.2024.2315
-
Li W, Titov AA, Morel L. An update on lupus animal models. Curr Opin Rheumatol. 2017;29(5):434-441. doi:10.1097/BOR.0000000000000412
-
Murphy ED, et al., Autoimmunity and lymphoproliferation: Induction by mutant gene lpr, and acceleration by a male-associated factor in strain BXSB mice, in Genetic Control of Autoimmune Disease. 1978:207-20.
-
Šakić B. The MRL Model: A Valuable Tool in Studies of Autoimmunity-Brain Interactions. Methods Mol Biol. 2018;1781:259-285. doi:10.1007/978-1-4939-7828-1_14
-
Izui S, Kelley VE, Masuda K, Yoshida H, Roths JB, Murphy ED. Induction of various autoantibodies by mutant gene lpr in several strains of mice. J Immunol. 1984;133(1):227-233.
-
Morse HC 3rd, Roths JB, Davidson WF, Langdon WY, Fredrickson TN, Hartley JW. Abnormalities induced by the mutant gene, lpr. Patterns of disease and expression of murine leukemia viruses in SJL/J mice homozygous and heterozygous for lpr. J Exp Med. 1985;161(3):602-616. doi:10.1084/jem.161.3.602
-
Kelley VE, Roths JB. Interaction of mutant lpr gene with background strain influences renal disease. Clin Immunol Immunopathol. 1985;37(2):220-229. doi:10.1016/0090-1229(85)90153-9
-
Gu L, Weinreb A, Wang XP, et al. Genetic determinants of autoimmune disease and coronary vasculitis in the MRL-lpr/lpr mouse model of systemic lupus erythematosus. J Immunol. 1998;161(12):6999-7006. -
Wang Y, Nose M, Kamoto T, Nishimura M, Hiai H. Host modifier genes affect mouse autoimmunity induced by the lpr gene. Am J Pathol. 1997;151(6):1791-1798.




